Pijn
De wieg van onze beschaving ligt in het oude Griekenland en ik zou willen voorstellen om de Griekse arts Rufus van Ephesus aan het woord laten. Deze dokter beschrijft dat je bij pijn veel kunt afleiden uit het gedrag van de patiënt: "uit steunen, schreeuwen, zich van de ene zijde op de andere wentelen, radeloosheid, de manier van liggen, kleur, vermagering, de beweging van de handen. Want die verraadt direct waar het pijn doet." Ook waarschuwt hij de arts dat er patiënten zijn de "niet minder geraffineerd pijn simuleren dan de acteurs die op het toneel hun jammerkreten slaken."
In de tweede eeuw bewees Galenus dat hij een geniaal arts was: "Pijn is wat de patiënt voelt." Hij maakte onderscheid tussen spanningspijn, kloppende, zware, scherpe, stekende, verdovende en zwerende pijn. De aangetaste, pijnlijke zone werd grondig onderzocht op pathologische veranderingen om tenslotte de oorzaak van de pijn te achterhalen. Galenus begreep dat pijn door zenuwen naar het ruggenmerg geleid wordt en dat pijn in de hersenen waargenomen wordt. Hij beschouwde het ontbreken van pijnsensatie als een psychische stoornis of als een teken van hersenschade
De inzichten van de artsen uit de oudheid bleven twee millennia opgang maken; zelfs Descartes in de jaren 1600 dacht nog steeds over pijn als een eenvoudige reflex:
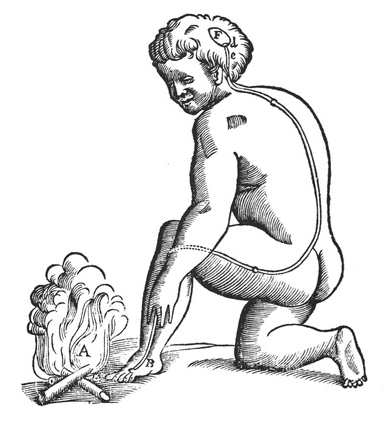
Deze tekening toont dat Galenus bijna hetzelfde dacht als Descartes 1400 jaar later.
Het grote probleem is dat deze visie nog 3 eeuwen als de specificiteit theorie van pijn gangbaar bleef tot in 1965 Melzack en Wall de poort controle theorie van pijn poneerden. Tot dan was er alleen "echte" pijn: pijn met weefselschade en "pijnklachten" zonder aantoonbare weefselschade waren in ieder geval niet "echt" en deze patiënten werden op zijn best niet ernstig genomen, op zijn slechtst gewoonweg beledigd.
Wat is pijn? De International Association for the Study of Pain (IASP) gebruikt de volgende definitie: "Pijn is een onplezierige, sensorische en emotionele ervaring die gepaard gaat met feitelijke of mogelijke weefselbeschadiging of die beschreven wordt in termen van een dergelijke beschadiging."
Uit deze definitie blijkt dat pijn minstens twee componenten heeft:
Een sensorische component: zoals bij zintuiglijke waarneming vertrekken er vanuit de periferie zenuwimpulsen naar het centrale zenuwstelsel.Een emotionele component: een “unpleasant” gevoel is eerder zacht uitgedrukt wanneer het over helse, levensbedreigende pijn gaat.
Het woord levensbedreigend brengt ons tot de functie van pijn:
Het brein creëert pijn om te overleven.
De hersenen evalueren voordurend de omgeving (intern en extern) en voorspellen de (nabije) toekomst zodat het organisme een grotere kans op overleven verwerft.
Sommige informatie is dringender dan andere: het op de lange baan schuiven van informatie over gevaar of schade kan dodelijk zijn. Het is dan ook geen toeval dat “gevaar” en “pijn” gelijkaardig door het lichaam verwerkt worden: het sensorisch zenuwstelsel zendt de informatie via een spoedprocedure naar het centrale systeem waar de volgende vragen gesteld worden: “Is dit een gevaarlijke situatie? Is mij dit eerder al eens overkomen? Welke maatregelen moet ik nemen om te overleven?”
Pijn is dus niet alleen een zintuiglijke waarneming zoals horen of zien, neen pijn is een emotie.
Emoties vertonen de volgende kenmerken:
1. Emotie dient om de biologische adaptatie te optimaliseren; emotionele fenomenen evolueerden om de overleving van het individu te bevorderen.
2. Emoties taxeren stimuli met een positieve of negatieve hedonische connotatie overeenstemmend met het biologisch belang van deze stimuli.
3. Het limbisch systeem (typisch voor zoogdieren) is de centrale neuroanatomische verwerkingseenheid van emoties.
4. Emoties lokken actie of zelfexpressie uit.
5. Emoties communiceren: negatieve emotionele expressie in het ene individu lokt bij anderen ook negatieve reacties uit
6. Menselijke emoties en humane cognitie zijn onderling verbonden en sterk van elkaar afhankelijk.
Wanneer wij “pijn” aan deze eigenschappen aftoetsen, stellen wij vast dat pijn aan elk van deze kenmerken voldoet en er één aan toevoegt: pijn is een erg opdringerige emotie die onze aandacht gijzelt.
Pijn –net zoals andere emoties- wordt vergezeld van gedragsveranderingen:
1. Gelaatsuitdrukkingen: grimassen, ogen sluiten of knipperen met de ogen
2. Geluiden: kreunen, schreeuwen, roepen
3. Terugtrek reflexen of andere motorische aanpassingen zoals verstijven
Dit gedrag wordt begeleid van lichamelijke veranderingen:
1. pupildilatatie, wijd, opengesperde ogen
2. veranderingen in bloeddruk, hartfrequentie
3. Veranderingen in ademhalingsritme en ademhalingssnelheid
4. piloerectie en zweten
5. verhoogde spiertonus
6. veranderingen in lichaams- en huidtemperatuur
7. verhoogde defecatie en mictie.
Deze fysiologische adaptaties worden door dierenartsen gebruikt om de ernst van de nociceptieve stimulus in te schatten en staat onder controle van de hypothalamus, die samen met de hypofyse via hormonen het lichaam –en vooral de bijnier- aanstuurt. De hypothalamus is bovendien niet alleen een centrale speler in het neuroendocrien stelsel, maar speelt ook een cruciale rol in werking van het autonome zenuwstelsel.
Dit was al zo bij onze verre voorouders, die als vis rondzwommen in de Silurische zeeën. Kunnen vissen pijn ervaren? Het is belangrijk in te zien dat wij het geobserveerde gedrag van vissen niet anthropomorfisch interpreteren omdat wij 400 miljoen jaar geleden evolutionair een heel andere weg ingeslagen zijn en omdat de structuren in onze hersenen die de basis vormen van de pijnbeleving van vrij recente (in evolutionaire termen tenminste...) oorsprong zijn. Vissen en zoogdieren delen de hersenstam terwijl de ontwikkeling van hersenhemisferen en de neocortex vooral bij de zoogdieren enorm belangrijk is. De neurologische basis voor bewustzijn is afhankelijk van een goed functionerende neocortex en vooral de associatieve cortex, deze is het verst ontwikkeld bij de mens. De neurale activiteit van de subcorticale regio's en de hersenstam is door het bewustzijn niet waar te nemen. Dit wil zeggen dat informatie over mogelijke lichaamsschade die daar verwerkt wordt, niet bewust kan gevoeld worden. Deze informatie kan wel aanleiding geven tot gedragsaanpassingen: bijvoorbeeld wanneer een vis aan een haak geslagen wordt, begint deze versnelde zwembewegingen uit te voeren om aan het gevaar te ontsnappen. Dit betekent niet noodzakelijk dat de vis pijn voelt: ook bij dreigend gevaar reageert het organisme van de vis op deze manier. Vissen zijn in staat om associatief, impliciet te leren dit wil zeggen dat deze dieren kunnen dingen onbewust leren. Een vis heeft geen grote neocortex (voor ons noodzakelijk om pijn te voelen) en wanneer men de neocortex verwijdert, dan blijft de vis nog steeds spartelen wanneer hij aan de lijn hangt.
Nociceptieve informatie bij vogels wordt naar het centrale zenuwstelsel geleid. Deze dieren hebben ook endogene opioiden die een modulerende rol spelen bij de verwerking van die informatie; bij vogels echter is het limbisch systeem (verantwoordelijk voor de gevoelens) niet of nauwelijks ontwikkeld: wat dit betekent voor waarnemen van "pijn" valt moeilijk in te schatten. Vogels stammen -net zoals onze voorouders- van reptielen af, maar kenden sedertdien een volledig onafhankelijke ontwikkeling, daarom leert het bestuderen van pijn bij vogels ons relatief weinig .
Niet alleen de centrale verwerking heeft een hele evolutie achter zich, ook de perifere nociceptieve pijngeleiding kende een belangrijke ontwikkeling omdat de systemen om pijnprikkels te geleiden uiterst belangrijk zijn voor het organisme om te overleven. In de loop der tijden ontwikkelde zich bij de zoogdieren dan ook de volgende systemen:
eerst het oudste systeem: de archispinothalamische tractus. Spinothalamisch wil gewoon zeggen van het ruggenmerg tot de thalamus -een belangrijke kern onderaan de hersenen-. Deze tractus is de oudste baan om schadelijke informatie van de periferie naar het centrale zenuwstelsel over te brengen. Het is een multisynaptisch (zoals een boemeltrein, vele stops, dus traag), diffuus (verspreid dus geen goede pijnlocalisatie mogelijk) systeem dat viscerale (misselijkheid, braken...) en autonome (zweten, hartkloppingen...) reacties op pijn uitlokt.
vervolgens het fylogenetisch tweede oudste systeem: de paleospinothalamische tractus. Dit systeem leidt niet alleen tot de thamus, maar ook naar de substantia reticularis, de periaquaductale neuronen (de spinoreticulaire baan) en het tectum (de spinotectale baan). Meer centraal zijn er verbindingen naar de kernen van de hersenstam. Dit is erg belangrijk omdat er vanuit die kernen afdalende zenuwbanen vertrekken die de pijn kunnen moduleren. Naast pijnprikkels, geleidt de paleospinothalamische baan ook thermische en mechanische informatie naar het centrale zenuwstelsel. Dit biedt therapeutische perspectieven: instinctief zijn wij geneigd om te wrijven wanneer wij ons pijn gedaan hebben of -aangeleerd- om ijs te leggen en zo de pijn te verminderen. Dit komt omdat het pijnsignaal dan met mechanische en thermische signalen in competitie moet treden om door te dringen tot de thalamus. Na een succesvolle behandeling treedt er vaak een warmte gevoel op in de voorheen pijnlijke zone: zou het kunnen dat dit fenomeen door de fysiologie van de paleospinothalamische tractus kan verklaard worden?
en tenslotte de neospinothalamische tractus. Deze baan is de fylogenetisch jongste tractus. Deze tractus kent weinig synapsen en is dus zeer snel. Bovendien is de pijnlokalisatie erg precies en dringt de pijn onmiddellijk tot het bewustzijn door.
Het nut van deze verschillende banen kan geïllustreerd worden met een voorbeeld:
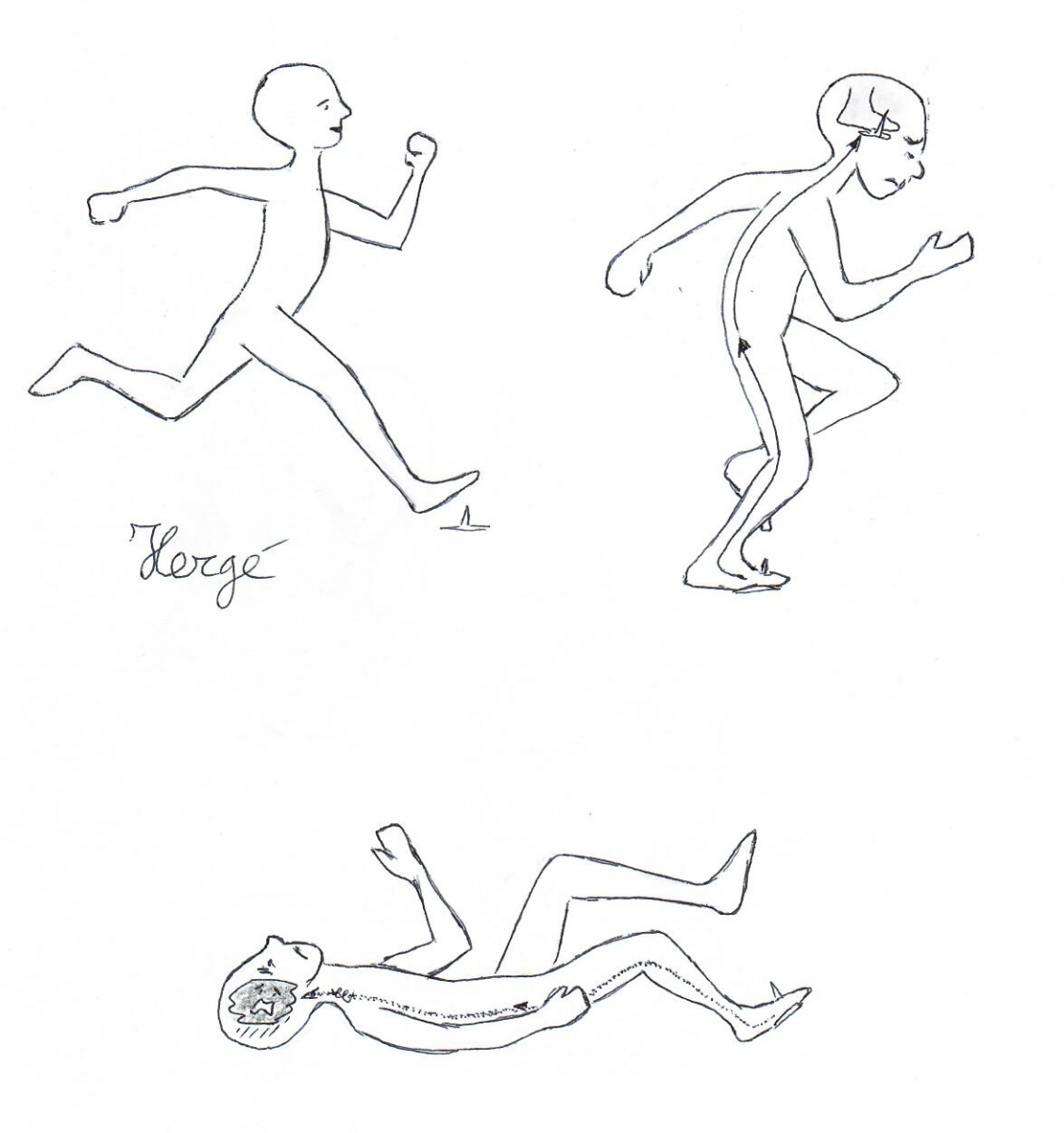
wanneer een nagel de voet perforeert, dan voelt men in een fractie van een seconde snelle, scherpe, goed gelokaliseerde pijn. Die pijn is nuttig omdat het lichaam dan onmiddellijk de gepaste reflexen (de voet ontlasten, zich laten vallen...) kan benutten om de schade te beperken. Deze scherpe, snelle, goed gelokaliseerde pijn (neospinothalamisch systeem) wordt na één tot twee seconden gecombineerd met een doffe, zeurende pijn (archi- en paleospinothalamisch systeem). Dit irritante gevoel duurt veel langer en maakt dat wij het gekwetste lichaamsdeel sparen zodat het vlotter kan genezen.
De hierboven vermelde zenuwbanen voorzien de achterkant van het hoofd en de rest van het lichaam van waarschuwingssystemen voor (dreigende) schade; dat deze alarmsystemen in de loop der millennia herhaaldelijk werden verbeterd, wijst op het belang ervan voor de evolutionaire fitness.
Het gelaat, mondholte en keel beschikken over andere mechanismen van nociceptie. HIer zijn de craniale zenuwen V, VII, IX en X (zenuwen die niet vertrekken vanuit het ruggenmerg, maar vanuit het centrale zenuwstelsel) verantwoordelijk voor schade rapportering.
Vooral de hersenzenuw nummer vijf (craniale zenuw V) of de trigeminus is de hoofdverantwoordelijke: deze wordt de drielingszenuw genoemd omdat de eerste tak (V 1) het voorhoofd, de tweede tak (V 2) de bovenkaak en de derde tak (V 3) de onderkaak bezenuwd. Alle drie de takken geleiden gevoels- en pijninformatie, de onderste tak stuurt ook de kaakspieren aan.
De craniale zenuw zeven of de facialis (VII) laat de spieren van het gelaat bewegen, craniale zenuw negen (IX) de glossopharyngeus en tien (X) de vagus projecteren net zoals de trigeminus hun informatie in de thalamus. De bovengenoemde neo-, paleo- en archi-spinothalamische banen eindigen ook in de thalamus. De trigeminus gebruikt zowel voor aanraking, positionering, temperatuur als schade rapportering de lemniscus als verbinding met de thalamus. Het archispinothalamisch systeem maakt ook gebruik van de lemniscus, zodat wij kunnen vermoeden dat de banen van het gelaat fylogenetisch zeer oud zijn.
Schade preventie of nociceptieve reactie op schadelijke prikkels is inderdaad een zeer oud universeel kenmerk van de dieren. Zelfs eenvoudige ongewervelden zonder hersenen reageren op dergelijke stimuli. Dit feit toont aan de actie op schadelijke prikkels hoegenaamd geen bewustzijn impliceert.
De thalamus ligt net boven de hersenstam; het is het primaire relais centrum van het brein. Hier wordt informatie van het ruggenmerg naar de verschillende delen van de hersenen gestuurd. Wij zullen hier heel kort de centra belangrijk voor de verwerking van pijnstimuli vermelden:
de somatosensorische cortex: hier wordt geanalyseerd van waar in het lichaam de pijn juist vandaan komt. De somatosensorische cortex wordt ingedeeld in primaire (S1) en secundaire (S2) zones. S1 ligt juist achter de motorcortex en de zenuwcellen van S1 zijn zo geordend dat informatie uit alle delen van het lichaam op afzonderlijke, goed gedefinieerde plaatsen van S 1 terechtkomt. Deze topografische organisatie zorgt ervoor dat wij ons onmiddellijk ervan bewust zijn waar de prikkel, die op S 1 toekomt, vertrekt. S2 ligt onder S1 in de temporale kwab. De zenuwcellen van S2 die reageren op pijn zijn niet talrijk, maar wel snel. Samen zorgen S1 en S2 dat men voelt waar er schade (geweest) is, welk soort letsel en hoe erg het is.
de anterieure cingulate cortex: dit deel van de hersenen is zeer oud en neemt deel aan autonome functies zoals bloeddrukregeling, spijsvertering en het regelen van de hartfrequentie. De anterieure cingulate cortex bezit "spindle neurons": deze zenuwcellen mag men gerust de luchtverkeersleiders van de emoties noemen: de informatie vanuit de amygdala wordt hier naar de frontale cortex afgeleid en dit is belangrijk omdat hier de affectief, emotionele lading van de pijn geëvalueerd wordt met andere woorden hoeveel wij "lijden". Hiermee samenhangend is voorste deel van de cingulate cortex ook verantwoordelijk voor het feit of wij acties (zowel cognitief, emotioneel als gedragmatig) tegen de pijn willen ondernemen.
de insula: ook de insula is een relatief oude structuur, die een belangrijke rol speelt in het overleven van het individu (verwerking van gegevens van smaak, viscerale informatie en autonome controle naast een belangrijk rol in cognitief, emotionele aspecten zoals empathie, zelfbewustzijn en emoties). De insula evalueert de context en het intern milieu. Hier worden honger, dorst, jeuk, pijn, verzadiging en fysieke integriteit waargenomen. Wanneer het lichaam zuurstof, suiker tekort heeft of wanneer er fysieke schade optreedt, dan luidt de insula de alarmbel. De insula creëert de mogelijkheid om de pijn van anderen te voelen en speelt waarschijnlijk een rol in het omzetten van homeostatische informatie naar bewustzijn.
de prefrontale cortex: dit deel van de hersenen is verantwoordelijk voor planning van een complexe cognitieve respons en in het moduleren van sociaal gedrag. Hier wordt de herinnering aan pijn, de betekenis van pijn en het omgaan met pijn bepaald. "Wat te doen met pijn" beslissingen worden in acties omgezet met de hulp van de anterieure cingulate en de motorische cortex.
In klinische proeven worden er bij dezelfde (thermische) stimulus zeer grote verschillen in pijnscore opgetekend; men schat dat erfelijke factoren voor 20 tot 60 % van de variabiliteit in pijnwaarneming verantwoordelijk zijn. Psychologische factoren zoals angst, somatisatie en catastrophizing (het buiten proporties opblazen van de ernst en het gevaar) spelen een grote rol. Bij de transit van de prikkel in de thalamus is er geen verschil; wel is er meer activiteit in de anterieure cingulate cortex, de primaire somatosensorische cortex en de prefrontale cortex bij meer pijngevoelige mensen.
Bij de verwerking van de nociceptieve informatie speelt bij alle zoogdieren –zoals hoger te lezen- het limbisch systeem een belangrijke rol, want het limbisch circuit van Papez -waar de emoties zetelen – beïnvloedt hypothalamus. De verschillende onderdelen van het limbisch systeem werken elkaar onderling zoveel mogelijk tegen in een poging om zelf een zo groot mogelijk effect op de hypothalamus uit te oefenen. Laat mij dit met een voorbeeld verduidelijken: wanneer de amygdala geprikkeld wordt door angst, lokt dit agressief gedrag uit. Wanneer daarentegen een andere limbische structuur – het septum- geprikkeld wordt , dan wordt agressie onderdrukt. Tussen de amygdala en het septum zijn er onderling inhiberende verbindingen. Hieruit blijkt ook dat het belangrijk is hoeveel synapsen de structuur van de hypothalamus verwijderd is: wanneer een kern via andere kernen de hypothalamus moet bereiken, dan mag men niet verwonderd zijn dat al die daaropvolgende kernen het signaal moduleren.
Pijn lokt een antwoord van het bewegingsstelsel uit om eraan te ontsnappen. Pijn activeert via de hypothalamus-hypofyse-bijnier-as de bijnierschors en pijn activeert ook het orthosympatisch zenuwstelsel. De twee manieren waarop dit zenuwstelsel werkt worden het vecht of vlucht antwoord genoemd. Wanneer de orthosympaticus de pijn als onontkoombaar interpreteert, dan wordt de “flight response” geactiveerd; de pijn geeft dan aanleiding tot ziekte gedrag, het sterk verminderen van de activiteit. Wanneer, integendeel, de pijn als beheersbaar ervaren wordt, zal de “fight response” geactiveerd worden: het lichaam vertoont een sterk toegenomen spierspanning en mobiliseert om aan de prikkel te ontsnappen.
Pijn is de enige manier om het lichaam te beschermen. Alhoewel het centrale zenuwstelsel de reactie op pijn coördineert, is het musculoskeletaal stelsel van kapitaal belang bij de uitvoering van deze defensieve strategieën.
Het is logisch dat er een groot verschil is tussen acute pijn (pijn minder dan 3 maanden) en chronische (pijn meer dan 3, volgens anderen 6 maanden): als indicator voor potentiële weefselschade , kan acute pijn als een adaptief alarm beschouwd worden, een alarm dat de aandacht richt op de plaats van de pijn en dat motiveert om actie te ondernemen om de schade te voorkomen of in ieder geval te beperken en in de toekomst vergelijkbare situaties te voorkomen. Wanneer wij over chronische pijn spreken wordt de zaak ingewikkeld: er treden leerprocessen op, neurobiologische, psychologische en sociale veranderingen, die de pijn kunnen bestendigen. In dit verband is het te begrijpen dat er bij chronische pijn aandacht dient gegeven te worden aan stemmingsstoornissen, verslaving en relationele problemen.
Waar bij acute pijn structurele informatie uiterst belangrijk is (bijvoorbeeld een echografie die een spierscheur in het licht stelt), is bij chronische pijn functionele informatie vaak veel interessanter, omdat deze functionele informatie een licht werpt op de motorische sturingsprogramma’s van het centrale zenuwstelsel, de werking van het perifere zenuwstelsel en de daarmee samenhangende sequentiële activatie van spiergroepen.
Bij acute pijn onderneemt het lichaam dus acties om eraan te ontsnappen. Dit is vanuit een evolutionair standpunt perfect logisch. Chronische pijn is een ander paar mouwen: ook hier er een motorisch antwoord op de pijnprikkel. Maar deze activiteit van de spieren is niet efficiënt. Het centrale zenuwstelsel plant dan nieuwe acties, maar ook deze acties blijven zonder positief resultaat. Zo ontstaan corrupte signalen die een domino effect hebben: er ontstaan compensatoire spierspanningen die in een nog groter dysfunctioneel bewegingspatroon uitmonden.
Bij chronische pijn zijn symptomen geen betrouwbare diagnostische indicatoren. Beschermende reflexen liggen aan de basis van de foute bewegingspatronen en domineren de pathologie. Zelden is de plaats van de pijn ook de oorzaak van de pijn.
Bovendien is de nosologie van blijvende pijn niet consistent:
sommige types van pijn zijn gebonden aan ziekteprocessen in specifieke weefsels: reumatoïde artritis, darmontstekingen, kanker, beschadigde zenuwen, weefsel anoxia (hartinfarct, sikkelcel anemie)
andere types van pijn worden geklasseerd volgens de lokalisatie: lage rugpijn, nek- en hoofdpijn, buikpijn
tenslotte zijn er de enigma’s zoals fibromyalgie of het prikkelbare darm syndroom, waar klinische noch laboratoriumonderzoeken onbetrouwbaar blijken in het aantonen van abnormale perifere weefsels op de plaats van de pijn. Bovendien komen deze syndromen vaak samen voor: het concept “central sensitivity syndome” beschrijft een overlappende, gelijkaardige groep van syndromen zonder structurele schade, maar met overgevoeligheid van het centrale zenuwstelsel.
Een andere classificatie van pijn baseert zich op de aard van de pijn:
Nociceptieve pijn: vaak acute pijn, is de normale response bij weefselschade.
Wij denken hier aan pijn afkomstig van de huid, het bewegingsstelsel en de perifere zenuwen: een initiële component is een snelle, goed gelokaliseerde, stekende pijn (neospinothalamische baan) gevolgd door een zeurende, brandende pijn (paleo- en archispinothalamische baan)
Ook gewrichten, pezen en fasciae kunnen nociceptieve pijn genereren; deze voelt dof, vervelend aan en wordt vergezeld van autonome symptomen (zweten, nausea, veranderingen bloeddruk, hartslag en ademhaling) (paleo- en archispinothalamische baan)
Viscerale pijn van de ingewanden kan door rek van de gladde spieren, tumoren, trombose of door chemische prikkeling ontstaan.
Neuropathische pijn wordt veroorzaakt door een primair letsel van het somatosensorische zenuwstelsel met sensitisatie. Kenmerkend voor neuropathische pijn is het invaliderend karakter en zijn sensorische afwijkingen zoals hyperalgesia of allodynie, doofheid, tintelen of paresthesieën. Voorbeelden hiervan zijn diabetische neuropathie, post herpetische neuralgie, pijn na ruggenmergletsels, fantoompijn, centrale pijn na beroerte.
Ontstekingspijn wordt geactiveerd door een gamma van mediatoren, die ontstaan op de plaats van weefselinflammatie. Voorbeelden zijn appendicitis en reumatoïde artritis.
Thalamische pijn, centrale pijn of het syndroom van DejerineRoussy kan optrede na een letsel van de thalamus door een beroerte. Thalamische pijnkan zich contralateraal uiten met sensorisch deficiet, ook is intracraniële hoofdpijn met gelaatspijn zonder sensorische uitval mogelijk.
Psychosomatische pijn wordt ervaren in verband met bepaalde gevoelens, vroegere ervaringen en zelfs suggesties. Veranderingen in de anterieure cingulate cortex zijn waarschijnlijk de oorzaak van deze pijn.
Referred pain wordt gevoeld in het gemeenschappelijke dermatoom; er zijn theorieën over convergentie ( bijvoorbeeld een viscerale pijnprikkel en imput uit de huid gebruiken dezelfde zenuwbanen) of facilitatie (een viscerale nociceptische prikkel bereikt de neocortex niet, maar faciliteert de spinothalamische baan waardoor de pijn op het betreffende huidgebied geprojecteerd wordt.
Fantoompijn of illusory pain is pijn zonder prikkeling van de nociceptoren omdat het lichaamsdeel er niet meer is.
Maar ook in deze classificatie weten wij geen weg met migraine of fibromyalgie.
Om deze reden gaan wij iets dieper in op deze ziektebeelden:
Migraine
Er zijn verschillende types van migraine, die vaak gepaard gaan met misselijkheid en overgeven.
Spanningsmigraine (een gevolg van stress) komt regelmatig terug en voelt als een pijnlijke druk op het hoofd, wordt vaak erger in de loop van de dag, vaak is de patiënt erg vermoeid zodat zij (of hij) met moeite de ogen kan openhouden. In- en doorslapen is gestoord, er zijn concentratiestoornissen, veralgemeende spierpijn en meestal zijn de patiënten nogal prikkelbaar.
De klassieke migraine begint vaak met grote gevoeligheid aan licht, lawaai of geuren
gezichtsvermogen is gestoord, flikkeringen en zelfs partiële blindheid, nausea,
afwisselend warm en koud, Bleek, duizelig en moe, éénzijdige hoofdpijn dikwijls in de buurt van de ogen, wel is de pijn duurt meestal kort (één uur), maar komt regelmatig terug, meestal op hetzelfde tijdstip van de dag of nacht (in het laatste geval gaat dit ten koste van de nachtrust), soms is er een exacerbatie na plotse bewegingen van het hoofd. Bij de aura speelt waarschijnlijk 'corticale spreading depressie' een rol, waarbij zich een golf van depolarisatie verplaatst over de hersenschors met als gevolg neurologische uitvalsverschijnselen.
De exacte oorzaak van migraine is niet gekend, maar zou polygenetisch en multifactorieel zijn; negatieve factoren zijn alcohol en andere voedingsmiddelen, ploegendienst, slaapstoornissen en stress.
Er zij twee hypothese
een reactie in het trigeminovasculaire gebied. Hierbij treedt een steriele ontstekingsreactie op in de buurt van de zenuwuiteinden rond de meningeale bloedvaten.
Lekken van spinale vocht: klachten (nausea, hoofdpijn, vermoeid) laat in de dag, beter door neerliggen, tinnitus
Vooral bij scoliose, na rugchirurgie, temporomandibulaire klachten. De oorzaak is vaak hyperlaxiteit van de gewrichten en de huid (makkelijk blauwe plekken, op 40 jaar cataract, prolaps hartkleppen, meest lange mensen), discusdegeneratie met calcificaties die drukken op de zenuwwortels en ook iatrogeen: na lumbale punktie of een epidurale infiltratie.
De diagnose wordt gesteld door middel van myelografie (CT-scan) en de behandeling is een epidurale bloedpatch of operatief (clipping)
Fibromyalgie
is een veel voorkomende chronische ziekte met een prevalentie (in de VS) van 2 – 5 % (vnl vrouwen van middelbare leeftijd, man/vrouw is 1/7)
Typisch voor de ziekte is hyperalgesie vaak samengaand met slaapstoornissen, vermoeidheid, ochtendstijfheid, cognitieve klachten en stemmingsstoornissen.
De etiologie is vooralsnog onduidelijk: er is toenemende evidentie voor een genetische component (polymorfisme in het COMT enzyme dat catecholamines afbreekt), er zijn ook omgevingsfactoren zoals fysiek trauma, infecties (hepatitis C en ziekte van Lyme) die fibromyalgie kunnen uitlokken en ook psychologische stress zou de ziekte kunnen initiëren.
Soms is de diagnose erg moeilijk wegens het samengaan met andere pathologie zoals artritis, autoimmuunziekten (reumatoïde artritis, lupus erythematodes disseminatus) en hypothyroidie).
Op dit ogenblik lijkt het meest waarschijnlijke mechanisme een falen van de afdalende pijnonderdrukkende banen in het centrale zenuwstelsel en dit in combinatie met een dysfunctie van het limbisch systeem. Het is namelijk zo dat pijn – zoals andere emoties- in het limbisch systeem verwerkt wordt; negatieve emoties vergroten de pijn uit. Ook op het niveau van het ruggenmerg treden er bij fibromyalgie veranderingen op.
Een voorbeeld zal dit verduidelijken: men verstuikt zijn enkel, de dag nadien voelt alles in de omgeving van de enkel dof en pijnlijk. Deze neuroplasticiteit maakt dat de enkel tijdelijk gespaard wordt en is nuttig voor het overleven van het dier. Bij fibromyalgie is de afzetknop van de neuroplasticiteit kapot en blijft de pijn voortduren.
Fibromyalgie is een centrale sensitisatie of een ziekte van het centrale zenuwstelsel en niet een musculaire, reumatische, articulaire en zeker niet een ingebeelde ziekte (men kan op beeldvorming afwijkingen in S 1 en S 2, de insulaire cortex, de anterieure cingulate cortex en in het cerebellum vaststellen).
Een behandeling is mogelijk, maar moeilijk: antidepressiva, analgetica, anti-epileptica, psychotherapie, kinesitherapie en gedragstherapie kunnen overwogen worden.